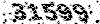انرژی پیوند و طول پیوند
بیا تو ادامه ببین چه خبره
انرژی پیوند( Bond Energies)
 عبارتست از تغییرات آنتالپی واکنش که در طی آن مولکولهای دو یا چند اتمی در حالت گازی تبدیل به اتمهای مربوطه میشوند. برای مثال:
عبارتست از تغییرات آنتالپی واکنش که در طی آن مولکولهای دو یا چند اتمی در حالت گازی تبدیل به اتمهای مربوطه میشوند. برای مثال:
 عبارتست از مقدار انرژی لازم برای شکستن پیوند.
عبارتست از مقدار انرژی لازم برای شکستن پیوند.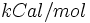 معلوم میدارد.
معلوم میدارد.
 نصف انرژی دیسوسیاسیون
نصف انرژی دیسوسیاسیون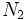 میباشد ولی انرژی دیسوسیاسیون آن چهار برابر
میباشد ولی انرژی دیسوسیاسیون آن چهار برابر  است که دلیل اصلی آن را میتوان به مرتبه پیوندی مربوط دانست. به مثال زیر توجه کنید.
است که دلیل اصلی آن را میتوان به مرتبه پیوندی مربوط دانست. به مثال زیر توجه کنید.مثال
 علت اختلاف انرژی پیوندی آنها را مشخص کنید.
علت اختلاف انرژی پیوندی آنها را مشخص کنید.
 و
و 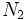 بیشتر است انرژی پیوندی آنها بیشتر از انرژی پیوندی
بیشتر است انرژی پیوندی آنها بیشتر از انرژی پیوندی  میباشد. پیوند دوگانه در
میباشد. پیوند دوگانه در 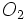 موجب میشود انرژی پیوند آن از انرژی پیوندی ساده مولکول
موجب میشود انرژی پیوند آن از انرژی پیوندی ساده مولکول بیشتر باشد.
بیشتر باشد.تمرین


و گاهی اوقات نیز شکستن یک پیوند ممکن است دو رادیکال مشابه تولید نماید:


اگر پیوند بین دو اتم مشخص نظیر 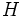 و
و 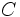 که در مولکولهای مختلف وجود دارند، در نظر گرفته شود، باید تأثیر مولکول دیگر پیوند شده با
که در مولکولهای مختلف وجود دارند، در نظر گرفته شود، باید تأثیر مولکول دیگر پیوند شده با 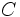 را بر روی انرژی پیوند مطالعه نمود. مثلاً: انرژی پیوند
را بر روی انرژی پیوند مطالعه نمود. مثلاً: انرژی پیوند جفت
جفت
هیدروکربورهای مختلف عبارتست از:
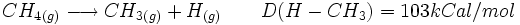


انرژی دیسوسیاسیون اتصالهای  در ترکیبات دیگر، بین 90 تا 103 کیلوکالری است. که در جدول میانگین انرژی پیوندی درج میشود.
در ترکیبات دیگر، بین 90 تا 103 کیلوکالری است. که در جدول میانگین انرژی پیوندی درج میشود.
ثبات تقریبی انرژی دیسوسیاسیون یا انرژی پیوند مفهوم جالبی دارد، زیرا در واقع نشاندهنده این است که خصوصیات اصلی دو اتم بوجود آورنده پیوند عامل اصلی تعیینکننده مقدار انرژی پیوند است. در حقیقت اتمها و یا رادیکالهای متصل به بقیه مولکول تأثیر کمی در مقدار انرژی پیوند این دو اتم بخصوص دارند. بنابراین، لزوم ایجاد یک نظریه که قادر به توجیه مشخصات پیوند شیمیایی برحسب خواص اصلی اتمهای متصله باشد، احساس میگردد.*}
کاربرد انرژی پیوند Use of Bond Energies
 ) یا هر پیوند دیگر از این نوع را به وسیله انرژی پیوند متوسط مشخص کرد، که عبارتست از انرژی تقریبی لازم برای شکستن اتصال در هر ترکیبی که این اتصال در آن وجود دارد. اختلاف انرژی متوسط
) یا هر پیوند دیگر از این نوع را به وسیله انرژی پیوند متوسط مشخص کرد، که عبارتست از انرژی تقریبی لازم برای شکستن اتصال در هر ترکیبی که این اتصال در آن وجود دارد. اختلاف انرژی متوسط 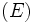 با انرژی پیوند در این است که انرژی دیسوسیاسیون عبارتست از مقدار انرژی که باید به یک ترکیب مشخص داد تا اتصال بخصوص آن شکسته شود و حال آنکه انرژی پیوند متوسط مربوط به کلیه ترکیباتی میشود که این پیوند بخصوص در آن وجود دارد. جدول زیر فهرستی از انرژی پیوند متوسط را نشان میدهد.
با انرژی پیوند در این است که انرژی دیسوسیاسیون عبارتست از مقدار انرژی که باید به یک ترکیب مشخص داد تا اتصال بخصوص آن شکسته شود و حال آنکه انرژی پیوند متوسط مربوط به کلیه ترکیباتی میشود که این پیوند بخصوص در آن وجود دارد. جدول زیر فهرستی از انرژی پیوند متوسط را نشان میدهد.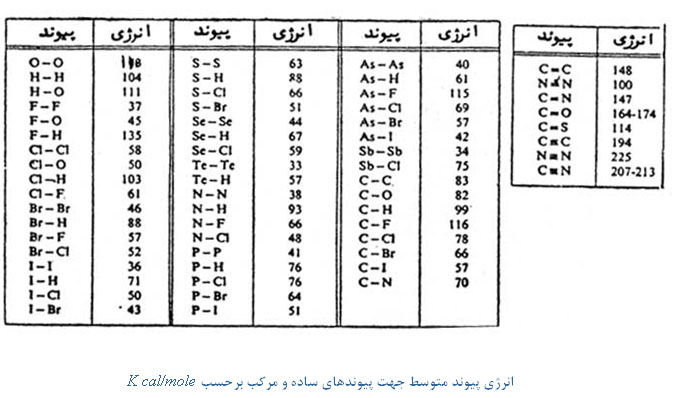
 یا انرژی آزاد شده در فشار ثابت را برای واکنش زیر بدین ترتیب حساب میکنند.
یا انرژی آزاد شده در فشار ثابت را برای واکنش زیر بدین ترتیب حساب میکنند.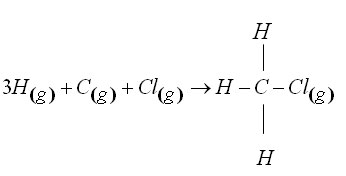
 برابر است با مجموع انرژیهای سه اتصال
برابر است با مجموع انرژیهای سه اتصال و یک اتصال
و یک اتصال  و چون سیستم فوق انرژی از دست داده است لذا
و چون سیستم فوق انرژی از دست داده است لذا با علامت منفی نشان داده میشود.
با علامت منفی نشان داده میشود.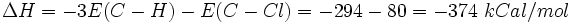
 مربوط به تشکیل
مربوط به تشکیل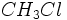 از عناصر کلر و کربن و هیدروژن بایستی رابطه زیر را نوشت:
از عناصر کلر و کربن و هیدروژن بایستی رابطه زیر را نوشت:



 را برای واکنش گازی معین کردیم ولی برای واکنش بعدی
را برای واکنش گازی معین کردیم ولی برای واکنش بعدی را میتوان برحسب انرژی دیسوسیاسیون پیوند
را میتوان برحسب انرژی دیسوسیاسیون پیوند و گرمای تبخیر گرافیت به اتم کربن گازی محاسبه نمود که عبارتست از:
و گرمای تبخیر گرافیت به اتم کربن گازی محاسبه نمود که عبارتست از: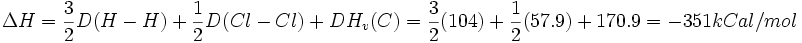


 بدست آمده به وسیله کالریمترهای خیلی دقیق برابر است با
بدست آمده به وسیله کالریمترهای خیلی دقیق برابر است با و بیان میکند که
و بیان میکند که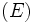 انرژی پیوند متوسط را میتوان با جزئی تقریب به جای انرژی پیوند جانشین کرد. از انرژی پیوند برای محاسبه گرمای ایجاد شده در واکنشهای مختلف هنگامی که به وسائل اندازهگیری (کالریمتری) دسترسی نباشد استفاده میگردد.
انرژی پیوند متوسط را میتوان با جزئی تقریب به جای انرژی پیوند جانشین کرد. از انرژی پیوند برای محاسبه گرمای ایجاد شده در واکنشهای مختلف هنگامی که به وسائل اندازهگیری (کالریمتری) دسترسی نباشد استفاده میگردد.الف.
 و ب.
و ب.  و ج.
و ج.  با یکدیگر مقایسه کنید.
با یکدیگر مقایسه کنید. علاوه بر مرتبه پیوند عاملی دیگری که در انرژی پیوندی مؤثر است جرم اتمی اتمهای تشکیلدهنده پیوند میباشد. با کاهش جرم اتمی انرژی پیوندی افزایش مییابد. ) به طور دقیقتر انرژی پیوندی به معکوس جرم کاهش یافته ربط دارد. جرم کاهش یافته مولکول دو اتم
 به صورت روبرو تعریف میشود.
به صورت روبرو تعریف میشود. 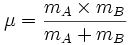 (
( یکی از دلایلی که موجب میشود
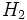 قویترین پیوند ساده در بین مولکولهای دو اتمی جور هسته را داشته باشد. جرم اتمی بسیار کوچک اتمهای هیدروژن است. وابستگی انرژی پیوندی به جرم را در قدرت پیوندی در مولکولهای دو اتمی هالوژنها (به استثنای
قویترین پیوند ساده در بین مولکولهای دو اتمی جور هسته را داشته باشد. جرم اتمی بسیار کوچک اتمهای هیدروژن است. وابستگی انرژی پیوندی به جرم را در قدرت پیوندی در مولکولهای دو اتمی هالوژنها (به استثنای ) به خوبی میتوان دید. عاملی که موجب کاهش انرژی پیوندی در مولکول
) به خوبی میتوان دید. عاملی که موجب کاهش انرژی پیوندی در مولکول  میگردد. دافعه شدید جفتهای غیرپیوندی در فاصله طول پیوندی نسبتاً کوچک
میگردد. دافعه شدید جفتهای غیرپیوندی در فاصله طول پیوندی نسبتاً کوچک  میباشد.
میباشد. همچنین دادههای جدول نشان میدهد انرژی پیوندی
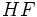 بسیار بیشتر از میانگین انرژیهای پیوندی
بسیار بیشتر از میانگین انرژیهای پیوندی  است. این تفاوت از قطبیت پیوند
است. این تفاوت از قطبیت پیوند 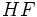 ناشی میشود. اختلاف الکترونگاتیوی دو اتم موجب ایجاد بارهای یکسان غیرهمنام بر روی دو اتم میشود. جاذبه حاصل از این بارها موجب کوتاه شدن طول پیوند و در نتیجه افزایش انرژی پیوندی میگردد.
ناشی میشود. اختلاف الکترونگاتیوی دو اتم موجب ایجاد بارهای یکسان غیرهمنام بر روی دو اتم میشود. جاذبه حاصل از این بارها موجب کوتاه شدن طول پیوند و در نتیجه افزایش انرژی پیوندی میگردد. بنابراین نظریه پیوندها به روشی ساده رابطه انرژی پیوند بعضی از مولکولها را با یکدیگر برای ما تفسیر خواهد کرد. گاهی اوقات ممکن است شکستن پیوند سبب بوجود آمدن رادیکال یا بخشی از مولکول گردد، مثلاً: در اثر شکستن مولکول آب رادیکالهای
 و
و 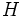 تولید میشود.
تولید میشود.