ساختار لوییس (رسم)
خیلی بدردت میخوره بیا تو ادامه مطلب
قواعد تعیین ساختار لوئیس
اولین و یکی از اساسیترین اطلاعات مورد نیاز در تعیین ساختار لوئیس مولکولها و یونهای چند اتمی آگاهی از آرایش اتمها نسبت به یکدیگر است. برای مثال در ترکیب گوگرد دیاکسید کدامیک از آرایشهای
کدامیک از آرایشهای 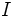 یا
یا  صحیح است؟
صحیح است؟
 کدامیک از آرایشهای
کدامیک از آرایشهای 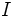 یا
یا  صحیح است؟
صحیح است؟
آرایش صحیح اتمها را میتوان با استفاده از روشهای تجربی (مانند روش پراش اشعه  ) تعیین نمود. علاوه بر روشهای تجربی، درک مفاهیم شیمیایی مانند ظرفیت، بار قراردادی و پایداری برخی از ساختارها نسبت به ساختارهای ممکن دیگر در پذیرش یا رد ساختار معینی کمک میکند. برای مثال در دو ساختاری که برای
) تعیین نمود. علاوه بر روشهای تجربی، درک مفاهیم شیمیایی مانند ظرفیت، بار قراردادی و پایداری برخی از ساختارها نسبت به ساختارهای ممکن دیگر در پذیرش یا رد ساختار معینی کمک میکند. برای مثال در دو ساختاری که برای معرفی شد، ساختار
معرفی شد، ساختار  بسیار ناپایدار است. بنابراین نمیتوان آن را به عنوان یک مولکول در اختیار داشت. علت ناپایداری آن بار قراردادی +1 بر روی اکسیژن میانی است در حالی که بار قراردادی اتمی با الکترونگاتیوی کمتر (گوگرد) -1 میباشد.
بسیار ناپایدار است. بنابراین نمیتوان آن را به عنوان یک مولکول در اختیار داشت. علت ناپایداری آن بار قراردادی +1 بر روی اکسیژن میانی است در حالی که بار قراردادی اتمی با الکترونگاتیوی کمتر (گوگرد) -1 میباشد.
 ) تعیین نمود. علاوه بر روشهای تجربی، درک مفاهیم شیمیایی مانند ظرفیت، بار قراردادی و پایداری برخی از ساختارها نسبت به ساختارهای ممکن دیگر در پذیرش یا رد ساختار معینی کمک میکند. برای مثال در دو ساختاری که برای
) تعیین نمود. علاوه بر روشهای تجربی، درک مفاهیم شیمیایی مانند ظرفیت، بار قراردادی و پایداری برخی از ساختارها نسبت به ساختارهای ممکن دیگر در پذیرش یا رد ساختار معینی کمک میکند. برای مثال در دو ساختاری که برای معرفی شد، ساختار
معرفی شد، ساختار  بسیار ناپایدار است. بنابراین نمیتوان آن را به عنوان یک مولکول در اختیار داشت. علت ناپایداری آن بار قراردادی +1 بر روی اکسیژن میانی است در حالی که بار قراردادی اتمی با الکترونگاتیوی کمتر (گوگرد) -1 میباشد.
بسیار ناپایدار است. بنابراین نمیتوان آن را به عنوان یک مولکول در اختیار داشت. علت ناپایداری آن بار قراردادی +1 بر روی اکسیژن میانی است در حالی که بار قراردادی اتمی با الکترونگاتیوی کمتر (گوگرد) -1 میباشد.به طور کلی برای تعیین آرایش اتمها نسبت به هم در یک مولکول از قواعد زیر استفاده میشود:
1.معمولاً اتمهای غیرفلز بزرگتر با الکترونگاتیوی کمتر و همچنین فلزات به عنوان اتم مرکزی عمل کرده و اتمهای غیرفلز الکترونگاتیوتر و کوچکتر به صورت اتمهای انتهایی آنها را احاطه میکنند. برای مثال در اتم حجیمتر کلر با اتمهای الکترونگاتیوتر و کوچکتر اکسیژن احاطه میشوند.
اتم حجیمتر کلر با اتمهای الکترونگاتیوتر و کوچکتر اکسیژن احاطه میشوند.
 اتم حجیمتر کلر با اتمهای الکترونگاتیوتر و کوچکتر اکسیژن احاطه میشوند.
اتم حجیمتر کلر با اتمهای الکترونگاتیوتر و کوچکتر اکسیژن احاطه میشوند.2.غالباً اتمهای اکسیژن، هیدروژن و هالوژن آرایش متقارنی اطراف اتم مرکزی دارند.
3.اگر در ترکیبی بیش از یک اتم کربن وجود داشته باشد، اتمهای کربن تمایل دارند با هم پیوند دهند.
4.اتمهای اکسیژن تمایلی برای پیوند دادن با هم ندارند مگر در پروکسیدها و سوپراکسیدها.
5.در اغلب اکسی اسیدها مانند و بسیاری از ترکیبات دیگر که حاوی اکسیژن و هیدروژن هستند غالباً این دو اتم به یکدیگر متصل هستند.
و بسیاری از ترکیبات دیگر که حاوی اکسیژن و هیدروژن هستند غالباً این دو اتم به یکدیگر متصل هستند.
 و بسیاری از ترکیبات دیگر که حاوی اکسیژن و هیدروژن هستند غالباً این دو اتم به یکدیگر متصل هستند.
و بسیاری از ترکیبات دیگر که حاوی اکسیژن و هیدروژن هستند غالباً این دو اتم به یکدیگر متصل هستند. 6.ساختارهای لوئیس ناپایدار باید از ساختارهای ممکن حذف شوند. معرفی و بحث در مورد قواعد مربوط به پایداری ساختارهای لوئیس را به مبحث رزونانس موکول میکنیم.
پس از آشنایی با چگونگی تعیین آرایش اتمها نسبت به همدیگر اینک در موقعیتی قرار داریم که میتوانیم از طریق مراحل زیر ساختار لوئیس گونههای شیمیایی را بدست آوریم. ضمن معرفی مراحل مختلف آنها را بر روی یون نیترات  به عنوان یک نمونه مثال، اعمال میکنیم:
به عنوان یک نمونه مثال، اعمال میکنیم:
 به عنوان یک نمونه مثال، اعمال میکنیم:
به عنوان یک نمونه مثال، اعمال میکنیم:1.مجموع تعداد الکترونهای لایه ظرفیت تمام اتمها را حساب کرده، اگر گونه شیمیایی یون باشد برای کاتیون به تعداد بار مثبت از مجموع الکترونها کم و اگر آنیون باشد به تعداد بار منفی به آن اضافه میکنیم. بنابراین برای یون نیترات خواهیم داشت:
خواهیم داشت: 
 خواهیم داشت:
خواهیم داشت: 
2.با توجه به قواعدی که قبلاً ذکر شد آرایش فضایی اتمها نسبت به همدیگر را تعیین میکنیم. در یون نیترات اتم نیتروژن که الکترونگاتیوی کمتری از اکسیژن دارد اتم مرکزی است و اکسیژنها اتمهای انتهایی هستند، پس آرایش اتمها در یون نیترات به صورت زیر است:

از قاعده 2 استفاده کرده و اکسیژنها را به شکل متقارن اطراف اتم مرکزی قرار میدهیم.
3.بین دو اتم مجاور دو الکترون پیوندی به صورت یک خط قرار داده سپس الکترونهای باقیمانده را مشخص میکنیم:
الکترونهای باقیمانده: 

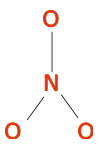
4.الکترونهای باقیمانده را به صورت زوجهای غیرپیوندی بر روی اتمها تا رسیدن به آرایش گاز نجیب اضافه میکنیم. اگر تعداد الکترونهای باقیمانده برای تکمیل آرایش هشتایی کلیه اتمها کافی نیست، ابتدا الکترونها را بر روی اتمهای الکترونگاتیوتر قرار داده و بقیه الکترونها به اتم یا اتمهایی با الکترونگاتیوی کمتر داده میشود، یعنی: 

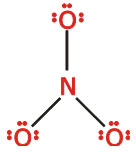
5.پس از توزیع تمام الکترونها، اگر همه اتمها از قاعده هشتایی تبعیت نمایند کار به پایان رسیده است. (یادآوری میشود قاعده هشتایی برای هیدروژن و مولکولهای با نقص الکترونی صادق نیست. برای هیدروژن قرار گرفتن دو الکترون اطراف آن کفایت میکند و در مولکولها با نقص الکترونی اطراف اتم مرکزی با کمتر از هشت الکترون وجود دارد، مانند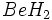 و
و  که به ترتیب چهار و شش الکترون دارند. این نوع کمبود الکترونی موجب خواص ویژهای در این ترکیبات میشود.) در غیر این صورت میتوان با تبدیل جفتهای غیرپیوندی به جفتهای پیوندی به طریق مناسب آرایش هشتایی تمام اتمها را کامل نمود. در مثال
که به ترتیب چهار و شش الکترون دارند. این نوع کمبود الکترونی موجب خواص ویژهای در این ترکیبات میشود.) در غیر این صورت میتوان با تبدیل جفتهای غیرپیوندی به جفتهای پیوندی به طریق مناسب آرایش هشتایی تمام اتمها را کامل نمود. در مثال  سه اکسیژن الکترون کامل دارند در حالی که نیتروژن شش الکترونی است، بنابراین به طریق زیر میتوان لایه ظرفیت آن را هشت الکترونی نمود:
سه اکسیژن الکترون کامل دارند در حالی که نیتروژن شش الکترونی است، بنابراین به طریق زیر میتوان لایه ظرفیت آن را هشت الکترونی نمود:
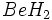 و
و  که به ترتیب چهار و شش الکترون دارند. این نوع کمبود الکترونی موجب خواص ویژهای در این ترکیبات میشود.) در غیر این صورت میتوان با تبدیل جفتهای غیرپیوندی به جفتهای پیوندی به طریق مناسب آرایش هشتایی تمام اتمها را کامل نمود. در مثال
که به ترتیب چهار و شش الکترون دارند. این نوع کمبود الکترونی موجب خواص ویژهای در این ترکیبات میشود.) در غیر این صورت میتوان با تبدیل جفتهای غیرپیوندی به جفتهای پیوندی به طریق مناسب آرایش هشتایی تمام اتمها را کامل نمود. در مثال  سه اکسیژن الکترون کامل دارند در حالی که نیتروژن شش الکترونی است، بنابراین به طریق زیر میتوان لایه ظرفیت آن را هشت الکترونی نمود:
سه اکسیژن الکترون کامل دارند در حالی که نیتروژن شش الکترونی است، بنابراین به طریق زیر میتوان لایه ظرفیت آن را هشت الکترونی نمود: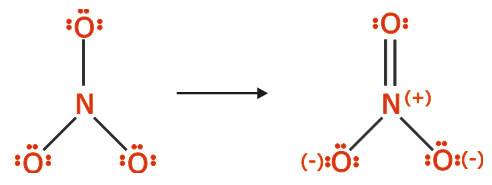
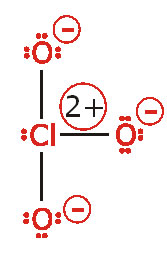
همانگونه که در ساختار لوئیس حاصل ملاحظه میکنید آرایش هشتایی تمام اتمها کامل است. مجموع بارهای قراردادی اتمها برابر با بار یون است و بار قراردادی مثبت بر روی اتم نیتروژن و بار قراردادی منفی بر روی اتم الکترونگاتیوتر اکسیژن قرار گرفته است. اکسیژن با بار قراردادی صفر دو ظرفیتی است (اکسیژن با پیوند دوگانه) و اکسیژنهای با بار قراردادی-1 یک ظرفیتی هستند (اکسیژنها با یک پیوند ساده) و نیتروژن با بار قراردادی+1 چهار ظرفیتی است.
مثال
ساختار لوئیس گونههای شیمیایی زیر را رسم کنید.
الف. 

ب. 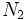
حل
الف. بر طبق قواعد ذکر شده مراحل تعیین ساختار لوئیس به صورت زیر است:

در این مثال عاملی که موجب قرار گرفتن بار قراردادی مثبت بر روی اتم الکترونگاتیوتر اکسیژن و بار قراردادی منفی بر روی کربن با الکترونگاتیوی کمتر شده است کامل شدن آرایش هشتایی کربن در اثر این عمل میباشد. بنابراین کامل شدن لایه ظرفیت اتمها مهمترین اصلی است که در ساختار لوئیس باید رعایت شود. البته در مواردی مانند و غیره آرایش هشتایی اتم یا اتمهایی کامل نمیشود و راهی برای تکمیل آن نیز وجود ندارد. در این موارد مولکولها از تمام قواعد ساختار لوئیس تبعیت نکرده و لذا بسیار ناپایدارند.
و غیره آرایش هشتایی اتم یا اتمهایی کامل نمیشود و راهی برای تکمیل آن نیز وجود ندارد. در این موارد مولکولها از تمام قواعد ساختار لوئیس تبعیت نکرده و لذا بسیار ناپایدارند.
 و غیره آرایش هشتایی اتم یا اتمهایی کامل نمیشود و راهی برای تکمیل آن نیز وجود ندارد. در این موارد مولکولها از تمام قواعد ساختار لوئیس تبعیت نکرده و لذا بسیار ناپایدارند.
و غیره آرایش هشتایی اتم یا اتمهایی کامل نمیشود و راهی برای تکمیل آن نیز وجود ندارد. در این موارد مولکولها از تمام قواعد ساختار لوئیس تبعیت نکرده و لذا بسیار ناپایدارند.ب. شبیه به  ، برای
، برای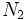 ساختار
ساختار  بدست میآید. همانگونه که مشاهده میکنید ساختار لوئیس
بدست میآید. همانگونه که مشاهده میکنید ساختار لوئیس 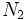 و
و  دقیقاً یکسان است. این دو مولکول را ایزوالکترون مینامند.
دقیقاً یکسان است. این دو مولکول را ایزوالکترون مینامند.
 ، برای
، برای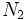 ساختار
ساختار  بدست میآید. همانگونه که مشاهده میکنید ساختار لوئیس
بدست میآید. همانگونه که مشاهده میکنید ساختار لوئیس 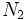 و
و  دقیقاً یکسان است. این دو مولکول را ایزوالکترون مینامند.
دقیقاً یکسان است. این دو مولکول را ایزوالکترون مینامند.سه مثال زیر را با شرح مرحله به مرحله رسم ساختارهای لوئیس پیش میبریم.
مثالهای زیر، چگونگی ترسیم ساختارهای لوئیس را نمایش میدهند. مراحل مختلف روش ترسیم در مثال اول شرح داده شدهاند
مثال1
ساختار لوئیس یون کلرات، ، را ترسیم کنید. اتم
، را ترسیم کنید. اتم 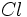 در این یون، اتم مرکزی است و سه اتم
در این یون، اتم مرکزی است و سه اتم 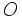 به آن پیوند شدهاند.
به آن پیوند شدهاند.
 ، را ترسیم کنید. اتم
، را ترسیم کنید. اتم 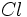 در این یون، اتم مرکزی است و سه اتم
در این یون، اتم مرکزی است و سه اتم  به آن پیوند شدهاند.
به آن پیوند شدهاند.حل
1.جمع تمام الکترونهای والانس اتمهای شرکتکننده در ساختار را پیدا کنید. تعداد الکترونهای والانس هر اتم عنصر نماینده با شماره گروه آن برابر است. برای هر بار منفی به شماره الکترونها یکی اضافه کنید و به ازای هر بار مثبت یون مورد نظر، از شماره الکترونها یکی کم کنید. تعداد کل الکترونهای والانس در عبارت است از:
عبارت است از:
 عبارت است از:
عبارت است از:7 الکترون (از اتم کلر)
18 الکترون (از سه اتم اکسیژن)
1 الکترون (از بار منفی یون)
---------------------
26 الکترون
2.تعداد الکترونهایی را که برای دادن دو الکترون به هر اتم هیدروژن و هشت الکترون به هر یک از اتمهای دیگر لازم است تعیین کنید.یون ، اتم هیدروژن ندارد.
، اتم هیدروژن ندارد.
 ، اتم هیدروژن ندارد.
، اتم هیدروژن ندارد. (تعداد سایر اتمها) 8 + (تعداد اتمهای هیدروژن)2 = تعداد الکترونهای لازم برای همه اتمها
(تعداد سایر اتمها) 8 + (تعداد اتمهای هیدروژن)2 = تعداد الکترونهای لازم برای همه اتمها3.تعداد الکترونهای بدست آمده در مرحله دوم منهای تعداد الکترونهای محاسبه شده در مرحله اول برابر تعداد الکترونهای مشترک در ساختار نهایی است.
(تعداد کل الکترونهای والانس) - (تعداد کل الکترونهای لازم برای هشتایی شدن اتمها) = تعداد الکترونهای پیوندی
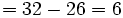 تعداد الکترونهای پیوندی
تعداد الکترونهای پیوندی4.تعداد جفت الکترونهای مورد استفاده در تشکیل پیوندها، نصف تعداد الکترونهای پیوندی (از مرحله سوم) است.
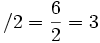 (تعداد الکترونهای پیوندی)=تعداد جفت الکترونهای پیوندی
(تعداد الکترونهای پیوندی)=تعداد جفت الکترونهای پیوندی4.نماد عناصر تشکیلدهنده یون را به نحوی بنویسید که اتم کلر در مرکز و اتمهای اکسیژندار در اطراف آن قرار گیرد. وجود پیوند ساده کوالانسی بین اتمها را با خطهای کوتاه، بین نمادهای اتمی نشان دهید. به این ترتیب، بین هر دو اتم، یک جفت الکترون مورد استفاده قرار میگیرد. اگر هنوز از جفت الکترونهای پیوندی محاسبه شده در مرحله چهارم باقیمانده است، آنها را برای تشکیل پیوند دوگانه یا سهگانه بین اتمها مورد استفاده قرار دهید (توجه کنید که  ، تنها پیوند ساده تشکیل میدهد).
، تنها پیوند ساده تشکیل میدهد).
 ، تنها پیوند ساده تشکیل میدهد).
، تنها پیوند ساده تشکیل میدهد).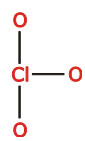
5.تعداد الکترونهای غیراشتراکی از تفاضل تعداد کل الکترونها (مرحله 1) و تعداد الکترونهای پیوندی (مرحله 3) بدست میآید. با نشان دادن الکترون به صورت نقطه، الکترونهای غیراشتراکی را تا تکمیل ساختار هشتایی (برای هیدروژن دوتایی) به دور اتمها بچینید.
 (تعداد الکترونهای پیوندی)- (تعداد کل الکترونها)= تعداد الکترونهای غیراشتراکی
(تعداد الکترونهای پیوندی)- (تعداد کل الکترونها)= تعداد الکترونهای غیراشتراکی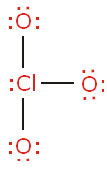
6.اگر اتمها بار قراردادی دارند آن را تعیین کرده، نشان دهید. بار قراردادی اتم کلر عبارت است از:
(الکترونهای غیرمشترک) – (الکترونهای مشترک)  (تعداد الکترونهای والانس کلر) = بار قراردادی
(تعداد الکترونهای والانس کلر) = بار قراردادی
 (تعداد الکترونهای والانس کلر) = بار قراردادی
(تعداد الکترونهای والانس کلر) = بار قراردادی  بار قراردادی
بار قراردادیبار قراردادی هر اتم اکسیژن عبارت است از:
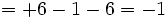 بار قراردادی اکسیژن
بار قراردادی اکسیژنپس، ساختار یون به صورت زیر است:
دقت کنید جمع جبری بارهای قراردادی که -1 است، برابر بار یون است.
مثال2
ساختار لوئیس مولکول  را ترسیم کنید. مولکول زاویهای است و دو اتم
را ترسیم کنید. مولکول زاویهای است و دو اتم  به اتم مرکزی
به اتم مرکزی 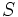 متصل است.
متصل است.
 را ترسیم کنید. مولکول زاویهای است و دو اتم
را ترسیم کنید. مولکول زاویهای است و دو اتم 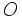 به اتم مرکزی
به اتم مرکزی 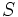 متصل است.
متصل است.حل
1.تعداد کل الکترونهای والانس در مولکول عبارت است از:
6 الکترون (از اتم 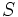 )
)
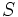 )
)12 الکترون (از دو اتم 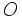 )
)
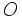 )
)------------------------
18 الکترون
2.
(تعداد سایر اتمها)8 + (تعداد اتمهای 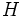 ) 2 = تعداد الکترون لازم برای پوشاندن همه اتمها
) 2 = تعداد الکترون لازم برای پوشاندن همه اتمها
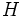 ) 2 = تعداد الکترون لازم برای پوشاندن همه اتمها
) 2 = تعداد الکترون لازم برای پوشاندن همه اتمها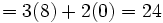 تعداد الکترون لازم برای پوشاندن همه اتمها
تعداد الکترون لازم برای پوشاندن همه اتمها 3.  (تعداد کل الکترونها) - (تعداد الکترونهای لازم برای اتمها)=تعداد الکترونهای پیوندی
(تعداد کل الکترونها) - (تعداد الکترونهای لازم برای اتمها)=تعداد الکترونهای پیوندی
 (تعداد کل الکترونها) - (تعداد الکترونهای لازم برای اتمها)=تعداد الکترونهای پیوندی
(تعداد کل الکترونها) - (تعداد الکترونهای لازم برای اتمها)=تعداد الکترونهای پیوندی4.  (تعداد الکترونهای پیوندی) = تعداد جفت الکترونهای پیوندی
(تعداد الکترونهای پیوندی) = تعداد جفت الکترونهای پیوندی
 (تعداد الکترونهای پیوندی) = تعداد جفت الکترونهای پیوندی
(تعداد الکترونهای پیوندی) = تعداد جفت الکترونهای پیوندی5. 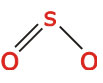

6.  (تعداد الکترونهای پیوندی) - (تعداد کل الکترونها)= تعداد الکترونهای غیرمشترک
(تعداد الکترونهای پیوندی) - (تعداد کل الکترونها)= تعداد الکترونهای غیرمشترک
 (تعداد الکترونهای پیوندی) - (تعداد کل الکترونها)= تعداد الکترونهای غیرمشترک
(تعداد الکترونهای پیوندی) - (تعداد کل الکترونها)= تعداد الکترونهای غیرمشترک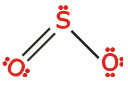
7.
(تعداد الکترونهای غیرمشترک) - (تعداد الکترونهای مشترک)  (تعداد الکترونهای والانس)=+ بار قراردادی
(تعداد الکترونهای والانس)=+ بار قراردادی
 (تعداد الکترونهای والانس)=+ بار قراردادی
(تعداد الکترونهای والانس)=+ بار قراردادیبرای اتم 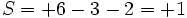 بار قراردادی
بار قراردادی
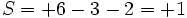 بار قراردادی
بار قراردادیبرای اکسیژن طرف چپ  بار قراردادی
بار قراردادی
 بار قراردادی
بار قراردادیبرای اکسیژن طرف راست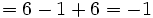 بار قراردادی
بار قراردادی
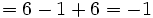 بار قراردادی
بار قراردادیساختار لوئیس به صورت زیر است:
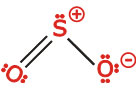
دقت کنید ساختار یکسانی میتوان ترسیم کرد که در آن پیوند دوگانه بین اتم گوگرد و اکسیژن طرف راست باشد.
مثال3
ساختار لوئیس نیتریک اسید،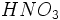 ، را ترسیم کنید. اتم
، را ترسیم کنید. اتم 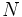 ، اتم مرکزی است که سه اتم اکسیژن به آن پیوند شدهاند. اتم
، اتم مرکزی است که سه اتم اکسیژن به آن پیوند شدهاند. اتم 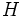 به یکی از اتمهای اکسیژن پیوند شده است.
به یکی از اتمهای اکسیژن پیوند شده است.
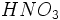 ، را ترسیم کنید. اتم
، را ترسیم کنید. اتم 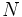 ، اتم مرکزی است که سه اتم اکسیژن به آن پیوند شدهاند. اتم
، اتم مرکزی است که سه اتم اکسیژن به آن پیوند شدهاند. اتم 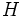 به یکی از اتمهای اکسیژن پیوند شده است.
به یکی از اتمهای اکسیژن پیوند شده است.حل
1.تعداد کل الکترونهای والانس مولکول عبارت است از:
1 الکترون ( از اتم 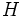 )
)
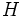 )
)5 الکترون (از اتم 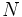 )
)
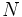 )
)18 الکترون (از سه اتم 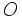 )
)
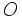 )
)--------------------------
24 الکترون
2. 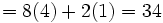 (تعداد سایر اتمها)+8 (تعداد اتمهای
(تعداد سایر اتمها)+8 (تعداد اتمهای 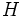 ) = 2تعداد الکترونهای لازم برای همه اتمها
) = 2تعداد الکترونهای لازم برای همه اتمها
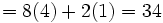 (تعداد سایر اتمها)+8 (تعداد اتمهای
(تعداد سایر اتمها)+8 (تعداد اتمهای 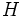 ) = 2تعداد الکترونهای لازم برای همه اتمها
) = 2تعداد الکترونهای لازم برای همه اتمها3.  (تعداد کل الکترونها) - (تعداد الکترونهای لازم برای همه اتمها)=تعداد الکترونهای پیوندی
(تعداد کل الکترونها) - (تعداد الکترونهای لازم برای همه اتمها)=تعداد الکترونهای پیوندی
 (تعداد کل الکترونها) - (تعداد الکترونهای لازم برای همه اتمها)=تعداد الکترونهای پیوندی
(تعداد کل الکترونها) - (تعداد الکترونهای لازم برای همه اتمها)=تعداد الکترونهای پیوندی4.  (تعداد الکترونهای پیوندی)= تعداد جفت الکترونهای پیوندی
(تعداد الکترونهای پیوندی)= تعداد جفت الکترونهای پیوندی
 (تعداد الکترونهای پیوندی)= تعداد جفت الکترونهای پیوندی
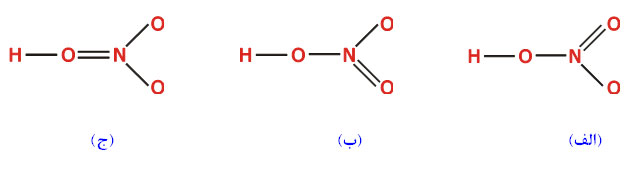
(تعداد الکترونهای پیوندی)= تعداد جفت الکترونهای پیوندی5.مولکول پنج پیوند دارد. اگر بین هر جفت اتم یک پیوند برقرار کنیم، تنها چهار جفت از این پنج جفت مورد استفاده قرار میگیرد و یک جفت باقی میماند که از آن برای برقراری یک پیوند دوگانه استفاده میشود. به این ترتیب سه امکان وجود دارد که با حروف (الف)، (ب) و (ج) نشان داده میشوند.
برای نمایش آواتار خود در این وبلاگ در سایت Gravatar.com ثبت نام کنید. (راهنما)




















































ایمیل شما بعد از ثبت نمایش داده نخواهد شد